Biyokimya I Ders Notları ( Yrd. Doç. Dr Kudret YILDIRIM )
•BİYOKİMYA I DERS NOTLARI
•Enzimler, Enzim Kinetiği, Enzim İnhibisyonu, Düzenleyici Enzimler ve Enzim Aktivitesinin Düzenlenmesi
•Enzimler
Enzimler canlılardaki reaksiyonları hızlandıran özel proteinlerdir Enzimler yan ürün oluşturmadan %100 verim sağlar Canlılardaki bütün kimyasal olaylar enzimlerce gerçekleştirilir Enzimler biyomoleküllerin hızlı bir şekilde reaksiyona girmesini sağlarlar Günümüzde 2000’den çok daha fazla enzim tanımlanmıştır Bu enzimlerin çoğu saflaştırılıp kinetikleri incelenmiştir 200’den fazla enzim ise kristallendirilmiştir Enzimler geçmişte etkiledikleri substratlarına göre adlandırılmıştır Mesala, üreyi CO2 ve NH3’e parçalayan enzime üreaz adı verilmiştir Arginini, ornitin ve üreye parçalayan enzime ise arginaz adı verilmiştir Aynı yıllarda substratlar hakkında bile bilgi vermeyen isimlerde kullanılmıştır Pepsin, tripsin, kimotripsin, katalaz… Zamanla enzim sayısının artması sistematik bir adlandırmayı mecburi kılmıştır Günümüzde enzimler Uluslararası Enzim Komisyonunca adlandırılır Yinede bir çok biyokimyacı enzimler için hala geleneksel isimleri kullanmaktadır Enzimlerin sistematik isimleri ise genellikle parantez içinde verilmektedir
Sistematik adlandırmanın temel özellikleri aşağıdadır
Reaksiyonlar ve reaksiyonları katalizleyen enzimler aşağıdaki 6 sınıfa ayrılmıştır. Oksidoredüktazlar, transferazlar, hidrolazlar, liyazlar, izomerazlar ve ligazlar Her bir sınıf ise kendi içinde 4-13 alt sınıflara ayrılmıştır Enzim adı 2 kısımda verilir İlk kısımda substrat(lar) verilir Substrat sayısı birden fazlaysa substratlar arasında : konulur İkinci kısımsa reaksiyon tipi hakkındadır ve grup veya alt grup adıdır Adlandırma için reaksiyon tipi sonuna –az eki getirilir Reaksiyon tabiatını açıklayan ifadeler ismin sonunda ve parantez içerisinde verilir Her enzime enzim kodu adı verilen sistematik bir kod verilir Bu kod E.C. harflerinden sonra gelen 4 rakamdan ibarettir (E.C. X.V.Y.Z.) Birinci rakam enzimin dahil olduğu sınıfı verir İkinci rakam enzimin dahil olduğu alt sınıfı verir Üçüncü rakam ise daha alt sınıfını verir Dördüncü rakam ise enzimin aynı ilk 3 rakama sahip enzimler arasındaki sırasını verir Enzim sınıflarını sırası ve örnekleriyle inceleyelim
Oksidoredüktazlar
Oksidoredüktazlar 2 substrat arasındaki redoks reaksiyonlarını katalizler Bu Sınıf dehidrogenazlar, oksidazlar, redüktazlar, oksijenazlar gibi enzimleri içerir “Alkol + NAD+ aldehit (keton) + NADH + H+ ” reaksiyonunu ele alalım Reaksiyonu katalizleyen enzimin geleneksel adı alkol dehidrogenazdır Bu enzimin sistematik adı ise Alkol:NAD+ oksidoredüktazdır Bahsedilen enzim için enzim kodu ise E.C. 1.1.1.1. ile verilmektedir
Transferazlar
Transferazlar belirli grupların 2 substrat arasındaki transferini katalizler H atomlarının 2 substrat arasındaki transferini oksidoredüktazlar katalizler “Asetil CoA + kolin CoA + O-asetil kolin” reaksiyonunu ele alalım Reaksiyonu katalizleyen enzimin geleneksel adı kolin açil transferazdır Enzimin sistematik adı ise Asetil CoA:kolin O-asetil transferaz Bahsedilen enzim için enzim kodu ise E.C. 2.3.1.6. ile verilmektedir
Hidrolazlar
Hidrolazlar, bazı bağların su katılımıyla parçalanmasını katalizler Ester, eter, peptid, glikozid, anhidrit, C-halojenür veya P-N bağları hidrolizlenir “Asetil kolin + H2O asetik asit + kolin ” reaksiyonunu ele alalım Bu reaksiyonu katalizleyen enzimin geleneksel adı asetil kolin esterazdır Enzimin sistematik adı ise asetil kolin asetil-hidrolazdır Enzim için enzim kodu ise E.C. 3.1.1.8. ile verilmektedir
Liyazlar
Liyazlar substratlardan belirli grupların ayrılması ile çift bağ oluşumunu katalizler Bu enzimler ayrıca çift bağlara çeşitli grupları ilave ederler “HCO3 – + H+ H2O + CO2” reaksiyonunu ele alalım Reaksiyonu katalizleyen enzimin geleneksel adı karbonik anhidrazdır Enzimin sistematik adı ise karbonat hidroliyazdır Bahsedilen enzim için enzim kodu ise E.C. 4.2.1.1. ile verilmektedir
İzomerazlar
İzomerazlar çeşitli izomerlerin birbirlerine dönüşümünü katalizler Mutaz, rasemaz, epimeraz gibi isimlerle anılan enzimler bu sınıfa dahildir “D-Gliseraldehit-3-fosfat dihidroksiaseton fosfat ” reaksiyonunu ele alalım Reaksiyonu katalizleyen enzimin geleneksel adı trioz fosfat izomerazdır Enzimin sistematik adı ise D-Gliseraldehit-3-fosfat ketolizomerazdır Enzim için enzim kodu ise E.C. 5.3.1.1. ile verilmektedir
Ligazlar
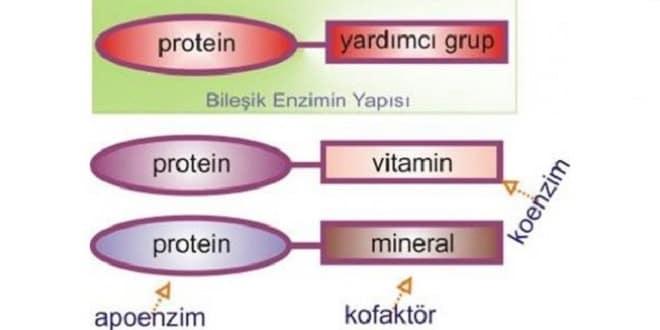
Ligazlar iki substratın birbirlerine bağlanmasını katalizler Reaksiyon için gereken enerji ATP veya GTP hidrolizinden sağlanır “ATP + L-glutamat + NH4+ ADP + PO4-3 + L-glutamin” reaksiyonunu ele alalım Reaksiyonu katalizleyen enzimin geleneksel adı glutamin sentetazdır Enzimin sistematik adı ise L-glutamat : NH4+ ligaz (ADP) Bahsedilen enzim için enzim kodu ise E.C. 6.3.1.2. ile verilmektedir Bazı enzimler kataliz görevini sadece protein yapıları ile yerine getirir Bazı enzimler ise kataliz için bazı yardımcı faktörlere ihtiyaç duyar Bu yardımcı faktörlere kofaktör adı verilir Kofaktörler metal iyonları veya kompleks bir organik bileşikte olabilir Kompleks organik bileşiklere ayrıca koenzimler adı verilir Katalitik açıdan aktif enzim-kofaktör kompleksine holoenzim adı verilir Kofaktörsüz enzime apoenzim denir Kofaktörsüz proteine ise apoprotein denir Çoğu enzim kofaktör ile sadece kataliz esnasında bir araya gelir Bazı kofaktörler ise enzimin sabit bir bileşenidir Enzimle her daim beraber olan bu kofaktörlere prostetik grup adı verilir Kofaktör olarak görev yapan metal iyonları 2 ayrı fonksiyonu vardır Bu iyonlar S ve E arası kordinasyon kompleksi için bir köprü işlevi görür Metal iyonları bizzat katalitik fonksiyona sahiptir Koenzimler genelde oksidoredüztazlar ve transferazlarla çalışır Elektronlar, belirli atom veya grupların transferinde görev alırlar Koenzimlerin çoğu B grubu gibi suda çözünen vitaminlerin türevleridir
Hayvanlar B grubu vitaminlerini sentezleyemeyip besinlerle hazır alırlar Kataliz için önce substratlar (varsa kofaktörler) enzime bağlanmalıdır Bağlanma aktif bölge denilen enzim üzerindeki özel bölgelerde gerçekleşir Aktif bölgeler özel bazı rezidüler* içeririler Bu rezidüler ile substratlar (varsa kofaktörler) enzimlerine bağlanır Ayrıca bahsedilen rezidüler katalitik aktiviteyi bizzat gerçekleştirebilirler Bundan dolayı bahsedilen rezidülere katalitik gruplar adı da verilir
Protein bünyesine dahil olan amino asitler
Enzimlerin aktif bölgeleri aşağıdaki ortak özelliklere sahiptir Aktif bölgeler enzimin çok küçük bir kısmını oluştururlar Enzim yapısındaki çoğu rezidüler substratla etkileşmez Aktif bölgeler 3 boyutlu bir yapılardır Normalde birbirinden çok uzak olan rezidüler aktif bölgede yan yana gelir Aktif bölgeler substratlara zayıf bağlarla bağlanırlar Ürünün oluşumu ve ayrılabilmesi için bağlanma tersinir olmalıdır Aktif bölgeler bir yarık ve girinti içerisinde yer alırlar Substratlar, suyun girmediği çukur bölgelere bağlanır Bu bölgeler bağlanma ve katalizden sorumlu polar gruplarda içerir Aktif bölgelerin yapısı spesifik bir bağlanmayı gerektirir Substrat enzime bağlanabilmek için özel bir yapıda olmalıdır
Anahtar-kilit modeli (E.H. Fischer)
Bazen ise substrat bağlanması aktif bölgenin şeklini değiştirebilir Etkileşme sonucu uygunluk modeli (D. E. Koshland) Enzimler katalizledikleri reaksiyon tipine oldukça spesifiktirler Genellikle tek bir reaksiyonu veya benzer bazı reaksiyonları katalizler
Enzimlerin substratlarına olan spesifikliği çok yüksek bazen mutlaktır Birçok enzim ayrıca stereospesifiktir Laktat dehidrogenaz sadece L-laktata etkilidir Glutamat dehidrogenaz sadece L-glutamata etkilidir Bazı enzimler ise geniş aralıkta bir spesifiklik gösterirler Mesala fosfatazlar benzer yapıdaki bir çok bileşiğe etkiler Enzimin substrata spesifikliği substratta 2 yapısal özelliğin olmasını gerektirir Substrat enzimin etkileyebileceği bir bağa sahip olmalıdır Substrat üzerinde bazı özel gruplar bulunmalıdır Bu gruplar enzime bağlanarak substratı katalitik bölgeye yaklaştırabilmelidir
•Enzim Kinetiği
Enzim kinetiği enzim reaksiyon hızlarını ve mekanizmalarını inceler Enzim kinetiği kimyasal kinetiğin temel prensiplerine uyar Kimyasal reaksiyonlar etkileşen reaktant sayısına göre sınıflandırılır Monomoleküler, bimoleküler ve termoleküler reaksiyonlar Kimyasal reaksiyonlar reaksiyon mertebelerine göre de sınıflandırılır Reaksiyon mertebesi hızı etkiyen reaktant konsantrasyonu sayısını verir 1° reaksiyonların hızı sadece bir reaktantın konsantrasyonuna bağlıdır Mesala, A P reaksiyonunu ele alalım Reaksiyonun hızı A’nın yok olma hızı veya P’nin oluşma hızıyla orantılıdır Herhangi bir t anındaki hız ifadesi aşağıdaki gibi verilir
V= d[P] / dt = – d[A] / dt = k [A] k hız sabitidir ve sıcaklıkla değişir
k [A] ifadesinin integrali alınıp logaritmada 10 tabanına göre yazılabilir
Bu durumda log [A0] / [A] = k x t / 2,303
[A0], başlangıç konsantrasyonu, [A] ise herhangi bir andaki konsantrasyondur
[A], t > 0 olduğu herhangi bir andaki konsantrasyondur
[A]= 0,5[A0] ise A maddesinin konsantrasyonunun yarıya düştüğünü gösterir
Bu arada geçen süre ise yarılanma süresidir ve t1/2 ile verilir
1° reaksiyonlar için t1/2= 0,693/ k’dir ve t1/2 başlangıç miktarından bağımsızdır
2° reaksiyonların hızı genelde 2 ayrı reaktantın konsantrasyonuna bağlıdır
Hız sadece bir reaktant konsanrasyonunun 2. kuvvetine de bağlı olabilir
Mesala, A + B P ve 2A P reaksiyonlarını ele alalım
İlk reaksiyonun hız ifadesi d[P] / dt = – d[A] / dt = – d[B] / dt = k [A] [B] olur. İkinci reaksiyonun hız ifadesi d[P] / dt = – d[A] / 2dt = k [A]2’ dir
A + B P reaksiyonu her zaman 2. mertebeden olmayabilir
Reaksiyon bazen birinci mertebeden gibi davranabilir
Mesala, [A] >> [B] ise hız sadece [B]’ye bağlıdır ve 1°’dendir
Kısaca reaksiyon mertebesi sadece reaktant sayısından anlaşılamaz
Reaksiyonun gerçekleştiği şartlarda dikkate alınmalıdır 3° reaksiyonlarına nadiren rastlanır Bazı reaksiyonların hızı ise hiçbir reaktanta bağlı değildir Bu tip reaksiyonlar sıfırıncı mertebedendir Çoğu enzim reaksiyonları sıfırıncı mertebedendir A’nın P’ye dönüştürürdüğü bir reaksiyon düşünelim A moleküllerinin P moleküllerine dönüşümü için bir enerji engeli aşılmalıdır Bahsedilen enerji engeline aktifleşme (aktivasyon) enerjisi (ΔG‡) adı verilir Yüksek enerjili (aktifleşmiş) A molekülleri hızla P’ye dönüştürülür Dönüşüm, gerekli bağın oluşumu veya parçalanması ile gerçekleşir Aktifleşme engelinin üst noktasına geçiş hali denir Her kimyasal reaksiyon için bir geçiş hali veya geçiş kompleksi vardır Geçiş hali, etkileşen moleküllerin enerjice zengin hallerini gösterir Bir reaksiyonun hızı geçiş hali konsantrasyonu ile orantılıdır Reaksiyon esnasında sıcaklık artırıldığında moleküllerin enerjisi artar Moleküllerin enerjisinin artması geçiş hali konsantrasyonunu artırır Geçiş hali konsantrasyonunun artışı ise reaksiyon hızını artırır. Katalizör adı verilen bazı maddeler ise aktifleşme engelini düşürür. Katalizörler reaktantlarla daha düşük enerjili geçiş halleri oluşturur Aktifleşme engelinin düşmesi ise reaksiyon hızını artırır Katalizörler reaksiyon hızını artırırken reaksiyon dengesini etkilemezler Katalizörler dengeye daha hızlı erişmeyi sağlar Katalizörler reaksiyondan değişmeden ayrılır Enzimler protein yapısında olan biyolojik katalizörlerdir Düşük [S] durumunda reaksiyon hızı [S] ile orantılı olarak artar Yani reaksiyon substrata göre birinci mertebedendir [S] artışı ile reaksiyon hızı artışında bir azalma gözlenir Reaksiyon mertebesi ise sıfırıncı ile birinci mertebe arasında bir mertebedendir
[S] artışı daha da artınca hız sabitleşir ve [S] artışı ile hız artmaz Bu durumda reaksiyon sıfırıncı mertebedendir Bu mertebede enzim molekülleri substratlarıyla bir arada yani doymuş haldedir Bütün enzimler sözü edilen doygunluk özelliğini gösterirler Farklı enzimler farklı [S] ile doygunlaşır Enzimler canlılarda çok az miktarlarda bulunur Bu sebebten dolayı enzimlerin miktarları değil aktiviteleri ölçülür Enzim aktivitesi ölçmek için ise enzimin katalizlediği reaksiyonun hızı belirlenir Enzim kinetiği enzimlerin katalizlediği reaksiyonların hızlarını inceler Michaelis ve Menten enzim kinetiğinin ilk öncüleri olmuşlardır Bazı özel kabullerle reaksiyon hızları ile ilgili aşağıdaki eşitlik elde edilir Yukarıdaki eşitlik Michaelis-Menten eşitliği olarak adlandırılır Michaelis-Menten eşitliği aşağıdaki kabullerle açıklanabilir
– Ürün (P)oluşumu öncesi bir enzim substrat kompleksi (ES) oluşumu gerekir – ES kompleksinin ürüne parçalanması en yavaş basamak olarak gerçekleşir Bu basamak enzimin gerçekleştirdiği reaksiyonun hızını belirler ES oluşumu ve ES’nin E ve S’ye ayrışımı çok daha hızlıdır
– Bir substrat molekülü sadece bir enzim molekülüne bağlanabilir
– [S] >>[E] olduğundan reaksiyonun en azından ilk dakikalarında [ES] sabittir
Reaksiyonun ilk dakikalarında hız [ES]’ye bağlıdır İlk 3 kabul Michaelis ve Menten’e aitken son kabul Briges ve Haldene’e aittir 4. kabül sadece enzimatik reaksiyonların ilk dakikaları için geçerlidir S, P’ye dönüştürüldükçe [S] düşer ve 4. kabul geçersizleşir Ayrıca P birikimi reaksiyonuda inhibe edebilir Yukarıdaki ifadede k1, k2 ve k3 hız sabitleridir Son kabule göre [ES] sabitken ES oluşum hızının ES parçalanma hızına eşittir Yani, ES oluşum hızı = ES parçalanma hızı veya k1 [E] [S] = k2 [ES] + k3[ES] olur [ES] + [E] = [Et] olarak alınıp yeni bir düzenleme yapılabilir [E], serbest E konsantrasyonu iken, [Et] ise toplam E konsantrasyonudur [ES] + [E] = [Et] ifadesinden [E] = [Et] – [ES] olarak alınabilir Bu durumda eşitlik k1 ([Et] – [ES]) [S] = k2 [ES] + k3[ES] olur Yukarıdaki ifade ise k1 [Et] [S] – k1[S] [ES] = k2 [ES] + k3[ES] olur k1[Et] [S] – k1[S] [ES] = k2 [ES] + k3[ES] ifadesinde k1 [Et] [S] yalnız bırakılır Yeni eşitlik k1 [Et][S] = k2[ES] + k3[ES] + k1 [S][ES] olur Bu eşitlik ise kısaca k1 [Et] [S] = [ES] (k2 + k3 + k1 [S]) ile verilebilir
[ES] yalnız bırakıldığında aşağıdaki eşitliğe erişilir Yukarıdaki eşitlikteki pay ve payda k1 değerine bölünebilir Yukarıda yeni eşitilikteki (k2 + k3) / k1 ifadesi Km veya Michaelis sabiti olarak bilinir Çoğu enzim için k2 >> k3 olduğundan k3 ihmal edildiğinde Km değeri k2 / k1 olur Km enzimin substratına olan ilgisinin bir ölçüsüdür Km değeri (k2 / k1) büyük olduğunda reaksiyon ES’nin E ve S’ye ayrıştığı yönde gerçekleşir Bu aynı zamanda enzimin substratına olan ilgisinin az olduğunu da gösterir Km değeri küçük olduğunda ise reaksiyon E ve S’den ES oluşumu yönünde gerçekleşir Bu ise enzimin substratına olan ilgisinin fazla olduğunu gösterir
Yukarıdaki eşitlikte (k2 + k3) / k1 yerine Km yerleştirildiğinde ise aşağıdaki gibi değişir Belirtildiği gibi reaksiyonun en yavaş gerçekleşen basamağı ES’nin E ve P’ye dönüşümüdür Bu nedenle reaksiyon için hız ifadesi v = k3[ES] veya v = k3[Et] olur
v = k3[ES] eşitliğindeki [ES] yerine [Et] [S] / [S] + Km ifadesi konulabilir Bu durumda yeni eşitlik aşağıdaki gibi olur Doygun bir [S] ve sabit bir [E] için maksimum ilk hızı Vmax olarak ifade edelim Bu durumda Vmax = k3[ES] veya Vmax = k3[Et] olur Hız denkleminde k3[Et] yerine Vmax yerleştirildiğinde ise Michaelis-Menten eşitliğine ulaşılır Yukarıdaki eşitlik tek substratlı enzimle katalizlenen reaksiyon için ilk hızı verir Eşitliğe göre herhangi bir andaki ilk hız o andaki Km, Vmax ve [S] ile belirlenir Eşitlik aynı zamanda v, Vmax ve [S] arasındaki kantitatif ilişkiyi gösteren bir ifadedir v, Vmax ve [S] birbirlerine kantitatif olarak Km sayesinde ilişkilendirilir Km , konsantrasyon birimleriyle ifade edilen bir parametredir v = Vmax / 2 olduğu bir anda ilk hız eşitliği v = 2v x [S] / (Km + [S]) olur Bu ifade aynı zamanda 2v x [S] = v (Km + [S]) demektir Eşitliğin her iki tarafı v ile bölündüğünde ise Km = [S] olur Kısaca Km, ilk hız Vmax / 2 olduğundaki substrat konsantrasyonudur Bu sebebten dolayı Km’nin konsantrasyon birimleri ile ifadesi normaldir Çoğu enzim için Km değeri 1 µM ile 10 mM arasında değişir Vmax ise genelde µmol ürün / dk / mg enzim olarak ile verilir Vmax ayrıca veya µmol ürün / dk / mol enzim olarak da verilebilir Herhangi bir enzim için Vmax ve Km değerleri deneysel olarak bulunabilir Vmax ve Km , v değerlerine karşı [S] değerleri grafiğinden elde edilebilir v değerlerine karşı [S] değerleri hiperbolik bir eğri verir Grafiğe göre v = Vmax olmayacağından Vmax ve Km değerleri tam bulunamaz Pratikte Vmax ve Km değerlerini elde etmek için daha farklı bir yol izlenir Bu amaçla Michaelis-Menten eşitliği farklı şekillerde bir doğru denklemine çevrilir Mesela Lineweaver-Burk eşitliğini ele alalım Lineweaver-Burk eşitliği Michaelis-Menten eşitliğinden elde edilir Michaelis-Menten eşitliği tersine çevrildiğinde Lineweaver-Burk eşitliği bulunur Eşitliğin y: m x + n ile ifade edilebilecek bir doğru denklemini verdiği görülür y: 1/v, m (eğim): Km /Vmax, x: 1/ [S] ve n ise doğrunun y- eksenini kestiği noktadır 1 / v değerlerine karşı 1 / [S] değerleri ile aşağıdaki grafik elde edilir Yukarıdaki grafiktekten Km ve Vmax değerleri kolayca hesaplanabilir Km ve Vmax değerleri Eadie-Hofstee eşitliği yardımı ile de bulunabilir Eadie-Hofstee eşitliğine Michaelis-Menten eşitliğinden ulaşılabilir Eşitliğin her iki tarafı önce Km + [S] ile çarpılır daha sonra ise [S]’ye bölünür Eadie-Hofstee eşitliği Lineweaver-Burk eşitliğinden de elde edilebilir Bunun için eşitliğin her iki tarafı Vmax ile çarpılıp yeniden düzenlenir Düzenleme sonucunda aşağıdaki Eadie-Hofstee eşitliği elde edilir Eadie-Hofstee eşitliğinin grafiği için v değerlerine karşı v / [S] değerleri alınır Aşağıdaki grafikten Km ve Vmax değerleri hesaplanabilir Km ve Vmax değerleri Hanes-Woolf eşitliği yardımı ile de bulunabilir Hanes-Wolff eşitliği Lineweaver-Burk eşitliğinden elde edilebilir Bunun için eşitliğin her iki tarafı [S] ile çarpılıp yeniden düzenlenir Düzenleme sonucunda aşağıdaki Hanes-Wolff eşitliği elde edilir Şu ana kadar hep tek substratlı bir enzimatik reaksiyondan bahsedildi Halbuki çoğu enzimatik reaksiyonlar birden çok substrat içerir Bu tip reaksiyonlar sonucunda sık sık birden fazla ürün oluşur Çok substratlı reaksiyonların mekanizmaları oldukça karmaşıktır Yinede bu tip reaksiyonların kinetikleri sık sık aşağıdaki eşitlikle verilebilir Eşitlik sadece A konsantrasyonunun değiştiği bir reaksiyon içindir
Diğer substratların konsantrayonu ise sabit kalmalıdır çalışmada elde edilen (gözlenen) Vmax değeridir çalışmada elde edilen (gözlenen) Km değeridir
Dersin bu kısmında ise daha ziyade iki substratlı enzimlerle ilgilenilecektir Hücrelerde gerçekleşen reaksiyonların çoğu iki substratlıdır Enzim için iki substrat olduğunda, basamakların sırası önem kazanır Basamakların sırası enzim mekanizmasını belirler Bu tip reaksiyonlar substrat bağlanma sırasına göre birkaç sınıfa ayrılır Substratların rastgele bağlandığı reaksiyonlar Substratların sırayla bağlandığı reaksiyonlar
Ping-pong reaksiyonları
Rastgele bağlanma gerçekleşirken substratlardan birisi ilk bağlanır Mesala, glukozun ATP ile fosforilasyonu bu tip bir reaksiyondur Reaksiyonu hekzokinaz enzimi gerçekleştirir Sıralı bağlanma gerçekleşirken substratlardan birisi ilk bağlanır Diğer substrat ise daha sonra bağlanır Bu tip reaksiyonlara bazı bileşiklerin NAD+ ile oksidasyonu örnektir Alkol dehidrogenaz bu tip reaksiyonları katalizler
Ping-pong reaksiyonlarında bağlanma çok daha farklı gerçekleşir İlk substrat bağlandıktan sonra ilk ürün oluşur Benzer şekilde ikinci substrat bağlandıktan sonra ikinci ürün oluşur Yukarıdaki E* enzimin bazı değişikliklere uğradığını gösterir Bir polipeptidin bazı proteazlar ile ikiye ayrılması bu tip bir reaksiyondur
•Enzim inhibisyonu
Enzim aktivitesi bazı kimyasalların etkisiyle azalır veya tamamen biter Enzim aktivitesini bu şekilde değiştiren kimyasallara inhibitör (I) adı verilir İnhibitörlerle gerçekleşen İki tip inhibisyon vardırr
Dönüşümsüz inhibisyonu
Dönüşümlü inhibisyonu
Dönüşümsüz inhibisyon
Bu inhibisyon genelde inhibitörün enzime kovalent bağlanması ile gerçekleşir İnhibitörler bazen enzimin aktivite için gereken bir kısmını kalıcı olarak değiştirir İnhibitörler ayrıca enzimle kararlı bir kovalent harici etkileşime girebilir
Dönüşümsüz inhibitörler enzim reaksiyon mekanizmaları hakkında bilgi verirler
Birçok zehirlenme olayının temelinde dönüşümsüz inhibisyon yatar
•İnhibisyonların grafik üzerinde incelenmesi
İnhibisyon tipi farklı [S] ve sabit [I] ile ölçülen reaksiyon hızlarından anlaşılabilir
Bunun için genelde ölçülen hızlara ait Linewear-Burk grafikleri kullanılır Yarışmalı inhibisyonda doğrunun eğimi değişirken 1/ v’yi kestiği yer aynı kalır [I] artırıldıkça doğrunun eğimi de artar Yarışmalı inhibisyonda yüksek [S] inhibisyonu kaldırır
[S] artırılınca inhibitörle yarışan S aktif bölgeyi tamamen doldurur Bu durumda enzim tam kapasite çalışır ve Vmax değişmez Doğru eğiminin inhibisyondaki artışı inhibitörün bağlanma kapasitesini gösterir Yarışmalı inhibisyon için Linewear-Burk eşitliği aşağıdaki gibidir Yarışmalı inhibisyonda doğrunun eğimi (1 + [I] / KI) çarpanı kadar artar Bu tip inhibisyonda inhibitör substrat bağlanmasını etkilediğinden Km değişir Km değerinin değişimi kadardır Mesala, Km= 10-4 olan enzim, I yokken v= Vmax / 2 değerine [S]= 10-4’ de ulaşır İnhibitör varlığında [I] = 2×10-3 M ve KI= 10-3 iken Km= 3×10-3 olur yani Km artar Klasik yarışmasız inhibisyon için Linewear-Burk eşitliği aşağıdaki gibidir Linewear-Burk grafiğinde doğrunun y-eksenini kestiği nokta yükselir Bir başka deyişle Vmax azalır ve azalma kadardır Km / Vmax ile verilen eğim ise aynı oranda artar Substrat bağlanması etkilenmediğinden Km değişmez KI ile ifade edilen inhibisyon sabiti KI : y0 [I] / yI – y0 eşitliğinden bulunabilir y0 inhibitörsüz reaksiyonda doğrunun y eksenini kestiği noktadır yI ise inhibitörlü reaksiyonda doğrunun y eksenini kestiği noktadır
Enzim aktivitesi çeşitli faktörlerden etkilenir
[S] [E] pH
Sıcaklık
İyonik şiddet
Kofaktör konsantrasyonu (kofaktör varsa)
İnhibitör ve aktivatör konsantrasyonları
•Enzim reaksiyon mekanizmaları
Bilinen çok sayıda enzim reaksiyonu vardır Yinede enzim reaksiyon mekanizmaları temelde birkaç tiptir Genel Asit-baz katalizi Geçiş-haline bağlanma ile kataliz Kovalent kataliz Metal iyon katalizi Reaktantların yakınlığı ve doğru yönlendirilmesi Elektrostatik kataliz Yapısal esneklik
Reaksiyonlar bu mekanizmaların bir kısmının kombinasyonu ile oluşur
Birçok enzim reaksiyonu genel asit-baz katalizi ile gerçekleşir
Bu tip kataliz için enzimler aktif bölge amino asit yan zincirlerini kullanır
Amino asit yan zincirleri genel asitler ve bazlar gibi davranır
Yan zincirler aktif bölgede proton transferleri için en uygun şekilde bulunur
His, Cys, Asp,Glu, Lys, Arg, Ser, Tyr yan zincirleri proton verir veya alır
Mesala protanlanmamış histidin genel bir baz gibi davranır
Protanlanmış histidin ise genel bir asit gibi davranır
Genel asit-baz katalizi en yaygın kataliz tipidir ve 3 şekilde gözlenebilir
Genel asit katalizi (General acid catalysis)
Genel baz katalizi (General base catalysis)
Eş zamanlı asit-baz katalizi (concerted acid-base catalysis)
Genel asit-baz katalizinde çeşitli asitler ve bazların protonları kullanılır
Spesifik asit-baz katalizinde sadece sudaki H+ ve OH- iyonları kullanılır
Enzimler bazen reaksiyonun geçiş haline de bağlanabilirler
Bunun sebebi bazı enzimlerin geçiş hallerine daha ilgili olmalarıdır
Enzimin geçiş haline bağlanması geçiş halinin konsantrasyonunu artırır
Bahsedilen artış ise reaksiyon hızını doğru orantılı olarak artırır
Geçiş haline bağlanan enzimler için bazı inhibitörlerler söz konusu olabilir
Bu inhibitörlere geçiş hali analogları adı verilir
Bazı doğal antibiyotikler geçiş hali analoglarıdır
Geçiş hali analogları ilaç tasarımı için oldukça önemlidir
Kovalent kataliz ayrıca nükleofilik kataliz olarak da bilinir
Geçici bir E-S kovalent bağının oluşumu reaksiyonu hızlandırabilir
Bu bağ bir nükleofilik grup ile elektofilik bir grup arasında gerçekleşir
Genelde nükleofilik grup E’de elektofilik grup ise S’de bulunur
E ve S arasındaki bağ yıkılınca ürün ve serbest enzim açığa çıkar
Kovalent kataliz, kimotripsin ve tripsin gibi enzimlerce gerçekleştirilir
Enzimlerin üçte biri kataliz için metal iyonlarına ihtiyaç duyarlar
Metaloenzimler metal iyonuna sıkıca bağlıdır
Fe+2, Fe+3, Cu+2, Zn+2, Mn+2, Co+2 …
Bu kofaktörlerin daha çok katalitik rolleri vardır
Metaller ile aktive edilen enzimler metal iyonlara geçici olarak bağlanır
Na+, K+, Mg+2, Ca+2…
Bu iyonlar daha çok yapısal rollere sahiptir
Metal iyonları katalize 3 temel şekilde dahil olur
Substrata bağlanarak onları reaksiyona uygun bir şekilde yönlendirler
Redoks reaksiyonlarını gerçekleştirirler
Negatif yükleri elektrostatik olarak sabitler veya gölgelerler
Enzimler reaktantları için uygun yakınlık ve yönlendirme sağlar
Böylece aktivasyon enerjisi düşürülür ve geçiş hali oluşabilir
Enzimler substratlarına bağlanarak reaksiyonları 3 şekilde kolaylaştırır Enzimler, substratları, varsa kofaktörleri ve katalitik gruplarının yakın olmasını sağlar Birbirlerine uygun yakınlıkta olma tek başına kataliz hızını 5 kat kadar artırır Enzimler, substratlarını reaksiyon için uygun yönelmeler ile bağlar Substratların etkileşecekleri kısımları birbirlerine bakacak şekilde olmalıdır Birbirlerine göre doğru yönelme tek başına kataliz hızını 100 kat kadar artırır Enzimler, substratlarının ve katalitik gruplarının bağıl hareketlerini sonlandırır Enzimler sayesinde geçiş halindeki etkileşen grupların bağıl hareketleri çok azalır
Bu etki tek başına kataliz hızını 107 kat kadar artırır Bazı enzimlerde aktivite elektrostatik kataliz ile gerçekleşir Substrat aktif bölgeye bağlanırken su genellikle aktif bölgeden uzaklaşır
Yani aktif bölge organik bir solventin polarite karakterlerine sahiptir Ortamın dielektrik sabiti suyun dielektrik sabitinden çok daha düşüktür Dielektrik sabitindeki düşme zıt yükler arasındaki etkileşimleri artırır Yani elektrostatik etkileşimler sulu çözeltilerdekinden çok daha güçlüdür Böyle bir ortamda aktif bölge amino asit yan zincirlerinin pK’ları oldukça değişir
Bunun sebebi komşuluğundaki diğer yüklü gruplardır
Aktif bölgenin uygun yerlerindeki bazı yüklü gruplar kataliz açısından önemlidir Bahsedilen yüklü gruplar ile reaksiyon geçiş halinin kararlılığı sağlanabilir Bu şekildeki bir etki ise reaksiyon hızını artırır Bazı enzimlerde kataliz için yapısal esneklikten faydalanılır Substrat önce enzime zayıf bir şekilde bağlanır
Bağlanma enzimin konformasyonunu değiştirir Konformasyon değişikliği geçiş haline ilgiyi artırır ve geçiş halini kararlı kılar
Bu gelişmeler aktivasyon enerjisini (ΔG‡) düşürür ve reaksiyon gerçekleşir
•Enzimatik reaksiyonların düzenlenmesi
Metabolik yollarda birden çok enzim beraber çalışırlar
Glikoliz, TCA devri…
Metabolik yollarda bir enzimin ürünü bir diğer enzimin substratıdır
Bu tip enzimlere multienzim kompleksleri adı verilir
Bu komplekslerdeki enzimler çeşitli şekillerde bulunabilirler
Enzimler birbirleri ile fiziki teması söz konusu olabilir (enzim kompleksi)
Yağ asidi sentetaz enzim kompleksi
Enzimler arasında fiziki bir temas olmayabilir
Glikoliz enzimleri
Enzimler membran gibi bir vasıta ile fiziki temas halinde olabilirler
Elektron taşıma sistemi (ETS)
Multienzim sisteminin kinetiği tekbir enzimin kinetiğinden farklıdır
Sistemdeki her enzimin substrat ve kofaktörler için ayrı ayrı Km değerleri vardır
Reaksiyonların hızını en yavaş basamağı gerçekleştiren enzim belirler
Hücrede metabolik yol ürünlerine hep aynı seviyede ihtiyaç olmaz
Bu nedenle bu yolların hızları hücre ihtiyaçlarına göre ayarlanmalıdır
Bahsedilen ayarlamalar bazı enzimler tarafından gerçekleştirilir
Eğer enzimatik reaksiyonlar düzenlenirse metabolik yollar düzenlenir
Çoğu multienzim sistemi kendilerini düzenleyebilirler
Bu sistemlerin çoğunda artan son ürün metabolik yolun ilk enzimi inhibe eder
Metabolik yollardaki diğer ara bileşikler ise aynı şekilde davranamaz
Metabolik yolların hızını belirleyen enzimlere düzenleyici enzimler adı verilir
Multienzim sistemlerindeki çoğu düzenleyici enzimler ilk reaksiyonu katalizler
İlk basamağın hücrenin ihtiyaçlarına göre düzenlenmesi önemlidir
Düzenleyici enzimin birkaç basamak sonra olması sakıncalı olabilir
Başka metabolik yollar için gerekli olan enerji ve yapıtaşı israf edilebilir
Bir metabolik yol için birden fazla ürün de söz konusu olabilir
Bu durumda düzenlenme dallanma noktalarındaki enzimlerle sağlanabilir
Düzenleyici enzimler aşağıdaki bazı ortak özelliklere sahiptir
Düzenleyici enzimlerin çoğu allosterik enzimlerdir
Bu enzimlerin aktivitesi kendilerine bağlanan bazı moleküllerin etkisi ile değişir
Enzime bağlanan moleküller hücre içi enerji veya yapı taşı gibi ihtiyacları gösterir
Bu şekilde metabolik yollar hücrelerin ihtiyacına göre düzenlenir
Düzenleyici enzimler reaksiyonlarını dönüşümsüz olarak katalizlerler
Enzimin reaksiyonu gerçekleşmesi halinde metabolik yol tamamlanır
Düzenleyici enzimler farklı dokularda farklı aktiviteli formlara yani izozimlere sahiptirler
Metabolik yollar her doku için aynı derecede önemli değildir
İzozimler ile farklı dokulardaki metabolik yollar, dokuların ihtiyaçlarına göre düzenlenir
Düzenleyici enzimlerin hücre içi ömrü çok daha kısadır
Bu enzimlerin sentezi transkripsiyon (mRNA sentezi) seviyesinde düzenlenir
Hormonlar ve hücre içi bazı kimyasallar bu enzimleri sentez ve yıkımını etkileyebilir
Bu kimyasallar düzenleyici enzimlerin sentezini teşvik edebilir veya baskılayabilir
Düzenleyici enzimlerin kısa ömürlü olması değişen şartlara uyumu kolaylaştırır
•Enzim kinetiği soruları
Soru 1
Bir enzim A B + H2O reaksiyonunu katalizlemektedir
A için Km: 1 µM , Vmax : 8 µmol ürün / dk / mg enzim
Çözeltideki [A] : 50 µM iken 1 mg enzim ile 2 dakikada kaç µmol B oluşur?
Cevap
v: Vmax [S] / Km+ [S]’den v: (8 µmol ürün / dk)x(5×10-5 M) /10-6 M + 5×10-5 M olur
v: (8×10-6 mol / dk)x(5×10-5 mol / L) / 10-6 mol / L + 5×10-5 mol / L
v: 400×10-12 / 51×10-6 mol /dk : 7.84×10-6 mol / dk
v : 7.84 µmol / dk / mg enzim
mg enzim başına 2 dakika ise 2 x 7.84 : 15.68 µmol ürün oluşur
Soru 2
Bir enzim A B + H2O reaksiyonunu katalizlemektedir
1 mL’deki 0.1 mg enzim için [A] aşağıdaki gibi değişmektedir
t:0 dk iken [A] : 0.1 µmol / 1.0 mL, t:1 dk iken [A] : 0.09 µmol / 1.0 mL
Vmax: 0.5 µmol ürün / dk / mg enzim ise A substratı için Km nedir?
Enzim Michaelis-Menten kinetiğine uymaktadır
Cevap
v: µmol ürün / dk / mg enzim olduğundan µmol ürün / dk hesaplanmalıdır
Reaksiyon stokiyometrisine göre tüketilen A kadar B oluşur
Tüketilen µmol A: 0.1 – 0.09 : 0.01 µmol / dk oldugundan
v: 0.01 µmol / dk / 0.1 mg enzim veya kısaca v: 0.1 µmol / dk / mg enzim olur
Reaksiyon başında [A] : [S] : 0.1 µmol / 1.0 mL : 100 µmol / L : 100 µM’dir
v: Vmax [S] / Km + [S]’den 0.1: 0.5 x 100 / Km + 100 ve 0.1 Km+10: 0.5 x 100 olur
0.1 Km+10: 0.5 x 100 ise 0.1 Km : 50 -10 olduğundan Km:40/ 0.1 : 400 µM olur
Soru 3
Laktaz enzimi laktoza galaktoz ve glukoza yıkmaktadır
Laktoz için Km 0.9 mM iken Vmax ise 3.5 µmol/dk/mg laktaz olsun
Ortamda 5.7 µmol laktoz ve reaksiyon karışım hacmi ise 80 mL olsun
1 mg laktaz tarafından 1 dakikada kaç µmol glukoz oluşturulur ?
Cevap
1 mg laktaz ile 1 dakikada oluşan glukoz miktarı ile aslında v sorulmaktadır
Önce [S] hesaplanır
[S] : 5.7 µmol laktoz / 0.080 L: 71.25 µmol/ L veya 71.25 µM olur
Daha sonra ise Km’de µM cinsinden alındığında 900 µM olur
v: Vmax [S] / Km+ [S]’den v: 3.5 µmol/dk /mg(71.25 µM) /900 µM + 71.25 µM olur
v:0.26 µmol / dk / mg laktaz
mg enzim başına dakika da 0.26 µmol glukoz oluşur
Soru 9
Aşağıdaki tabloya göre Km ve Vmax değerlerini hesaplayınız
Grafikten farklı [S] için birim zamanda ilk hızlar (v) elde edilir
Grafikten de görüleceği 60. saniyeden sonra hiperbolik eğriler gözlenmektedir
Bu yüzden 60. saniyeden sonraki ilk hızlar dikkate alınamaz
Grafikten sadece 60. saniyeye denk gelen ilk hızlar dikkate alınır
Daha sonra 1/ v ve 1/ [S] değerleri hesaplanır
1/ v ve 1/ [S] değerleri kullanılarak Lineweaver-Burk grafiği hazırlanır
Soru 10
Aşağıdaki tabloya göre Km ve Vmax değerlerini hesaplayınız
Grafikte farklı [S] için birim zamanda (dk) oluşan nmol P yani ilk hızlar gözlenir
Grafikten de görüleceği 3. dakikaya kadar hiperbolik eğriler gözlenmemektedir
Bu nedenle 1 dk için ortalama ilk hızlar dikkate alınır
Daha sonra Lineweaver-Burk grafiği için 1/ v ve 1/ [S] değerleri hesaplanır
•KAYNAKLAR
1- Keha, E. E. ve Küfrevioğlu, Ö.İ., Biyokimya, Dördüncü baskı, Aktif Yayınevi, Erzurum, 2005.
2- Nelson, D.L. and Cox, M.M., Lehninger Principles of Biochemistry, Fourth edition, Worth Publishers Inc., USA, 2004.
3- Garret, R.H. and Grisham, C.M., Biochemistry, Second edition, Saunders College Publishing, USA, 1999.
4- Mathews, C.K. and van Holde, K.E., Biochemisrty, Second edition, Benjamin/Cummings, USA, 1996.
5- Koolman, J. and Roehm, K-H., Color Atlas of Biochemistry, Second Edition, Germany, 2005.
6- Magill, J.M., Problem Solving in Biochemistry; A Practical Approach, Macmillan Pub Co, USA, 1988.
7- Voet, D., Voet, J.G., Pratt, C.W., Fundamentals of Biochemistry, First Edition, John Wiley & Sons, Inc., New York, USA, 1999.
8- Kuchel, P.W., and Rallston, G.B., Biochemistry, McGraw-Hill, USA, 1998.
9- Hames, B.D. and Hooper, N.M., Instant Notes in Biochemistry, Second edition, Bios Scientific Publishers, UK, 2000.
10- Onat, T., Emerk, K., Sözmen, E.Y., İnsan Biyokimyası, Birinci Baskı, Palme Yayıncılık Ankara, 2002.
11- Pamuk, F., Biyokimya, Gazi Kitabevi, Ankara, 2000.
…